| Autor |
Nachricht |
|
GerlindeHuber
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 19.11.2009, 17:37 |
|
| Versuchskaninchen |
 |
 |
Registriert: 13.09.2009, 14:27
Beiträge: 37
|
Falls irgenwer 3.3 und 3.4 richtig haben sollte könnte er die Beispiele reinstellen, habe sie leider falsch gerechnet  Wär wirklich wichtig,.... lg
|
|
  |
|
 |
|
Perchlor
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 19.11.2009, 18:50 |
|
| Versuchskaninchen |
 |
 |
Registriert: 09.11.2009, 14:10
Beiträge: 41
|
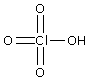
Hi, also ich habs folgendermaßen gerechnet: 10 mL NH3 Lösung entsprechen 9,1g (wegen der Dichte=0,91) Davon sind 25% reiner NH3 also 0,25*9,1 also 2,275 g reiner NH3 M(NH3)=17,0304 g/mol n=m/M n(NH3)=0,13358 mol Dann haben wir 5g NH4Cl => M(NH4Cl)= 53,49 g/mol Jetzt wieder n=m*M --> n(NH4Cl)=0,0934 mol 100mL = 0,1 l c(NH4Cl)=0,0934/0,1=0,934 mol/l c(NH3)=0,13358/0,1=1,3358 mol/l Nun in die Henderson-Hasselbach Gleichung einsetzen: [OH]= KB * [NH3]/[NH4Cl] [OH]= 1,8*10^-5 * (1,3358/0,934) [OH]=2,5*10^-5 pOH= -log(2,5*10^-5) pH= 14-pOH= 9,41 Dafür hab ich zumindest den Punkt bekommen  lg _________________ Never play Hide and Seek with a homicidial maniac - they always win
Zuletzt geändert von Perchlor am 24.11.2009, 09:07, insgesamt 1-mal geändert.
|
|
  |
|
 |
|
GerlindeHuber
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 19.11.2009, 18:54 |
|
| Versuchskaninchen |
 |
 |
Registriert: 13.09.2009, 14:27
Beiträge: 37
|
|
danke ist voll lieb von dir!
|
|
  |
|
 |
|
Neuling
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 19.11.2009, 19:35 |
|
| Versuchskaninchen |
 |
 |
Registriert: 15.08.2009, 19:56
Beiträge: 19
|
Ja hab Beispiel drei auch einen Punkt für das Ergebniss bekommen also ist es 100% richtig  Ich habe echt Probleme bei 3.4 schon zwei mal abgegeben und wieder falsch  Hat das nicht irgendwer richtig, also der dafür einen Punkt bekommen hat und könnte es reinstellen? Lg
|
|
  |
|
 |
|
Waldi
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 19.11.2009, 21:10 |
|
| Versuchskaninchen |
 |
 |
Registriert: 30.09.2009, 07:02
Beiträge: 19
|
|
Kann wär bestätigen, dass bei 3.4 = 5,0mL rauskommt wenn ja würde meins stimmen, dann stell ich es online, meins ist noch nicht angeschaut worden daher weiß ich es leider nicht!
|
|
  |
|
 |
|
Kathi1808
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 19.11.2009, 22:02 |
|
| Mikroskopierer/in |
 |
 |
Registriert: 05.09.2009, 19:55
Beiträge: 204
|
|
Hey, ja ich hab auch grad das Bsp nochmal gerechnet und mir würde auch 5,0147ml rauskommen, hab aber kA ob es richtig is!?
|
|
  |
|
 |
|
GerlindeHuber
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 19.11.2009, 22:51 |
|
| Versuchskaninchen |
 |
 |
Registriert: 13.09.2009, 14:27
Beiträge: 37
|
bekomm jetzt auch das 5,0ml raus, vielleicht stimmts ja 
|
|
  |
|
 |
|
gwiazdka
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 19.11.2009, 23:03 |
|
| Versuchskaninchen |
 |
 |
Registriert: 25.06.2009, 10:33
Beiträge: 88
|
Perchlor hat geschrieben: Nun in die Henderson-Hasselbach Gleichung einsetzen: [OH]= KB * [NH3]/[NH4Cl] [OH]= 1,8*10^-5 * (1,3358/0,934) [OH]=2,5*10^-5 pOH= -log(2,5*10^-5) pH= 14-pOH= 9,41 Dafür hab ich zumindest den Punkt bekommen  lg Danke  hatte alles richtig bzw. genau wie du ... hab dann aber einmal bei der Henderson-Hasselbach Gleichung ein "+" statt einem "-" gerechnet und einen pH von 9,095 rausgekriegt und gleich mal 0 PUnkte gekriegt  aber jetz weiß ich wo mein Fehler liegt. @GerlindeHuber & Kathi1808 & Waldi:also ich hab 6,498 ml raus ...  Was sind denn manche von euren "Zwischenergebnissen"? > ich hab als neues c(HAc) = 0,09845 mol/l > dann als pH 2,878 > als ursprüngliche (c vor der Verdünnung) c(HCl) = 0,1323 mol/l > n(HCl)=0,0662 und dann war ich mir nicht sicher wie ich die 32% Massenanteil reinrechnen soll ... wie habt ihr das gemacht?
|
|
  |
|
 |
|
xxSTEPHANxx
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 20.11.2009, 10:07 |
|
| Versuchskaninchen |
 |
 |
Registriert: 16.09.2009, 11:34
Beiträge: 46
|
|
Die Punkteliste wurde ja heute wieder aktualisiert, kennt jetzt schon wer die richtige Lösung von den letzten Beispiel 3.4?
|
|
  |
|
 |
|
tgranditsch
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 20.11.2009, 12:33 |
|
| Eprouvettenschüttler/in |
 |
 |
Registriert: 29.09.2009, 18:39
Beiträge: 97
|
|
@Stephan, ich habe bei 3.2 für a,b und c genau die gleichen ergebnisse wie du, habe auch bei einheit pH hingeschrieben und auch null punkte bekommen.. hast du das gleiche nochmal abgegeben und diesmal ph weggealssen?
_________________ ******I'm rolling Thunder, pouring Rain - I'm coming on like a HURRICANE******
|
|
  |
|
 |
|
gwiazdka
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 20.11.2009, 12:39 |
|
| Versuchskaninchen |
 |
 |
Registriert: 25.06.2009, 10:33
Beiträge: 88
|
|
Hi!
Also ich hab mal die angeschrieben die für dei Einheit 3 zuständig war/is ... ich wollte wissen wie das is mit a)b)c), wann man da den Punkt kriegt ...
Die Antwort war, dass man den Punkt nur kriegt wenn man alle 3 richtig hat und die dann auch die richtige Einheit haben .... dann noch die Bemerkung: "Der pH-Wert hat KEINE Einheit!"
|
|
  |
|
 |
|
xxSTEPHANxx
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 20.11.2009, 12:43 |
|
| Versuchskaninchen |
 |
 |
Registriert: 16.09.2009, 11:34
Beiträge: 46
|
|
du vielleicht hab ich es auch weggelassen aber wann hab es so aufgeschrieben:
Einheit: ph=
Hab halt = dahinter geschrieben, daher gebe ich nicht wirklich es als Einheit an!
edit:
jemand hat nichts hingeschrieben und die Punkte bekommen also lass es lieber weg
|
|
  |
|
 |
|
VerenaT
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 20.11.2009, 13:01 |
|
| Versuchskaninchen |
 |
 |
Registriert: 17.10.2009, 07:16
Beiträge: 31
|
komschich habe nichts dazu geschrieben und auch keinen Punkt erhalten obwohl ich auch das selbe habt wie ihr  Die gehen mir echt schon auf die Nerven! Naja,... weiß den niemand was über das letzte Beispiel bescheid? ob das nun stimmt?
|
|
  |
|
 |
|
tgranditsch
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 20.11.2009, 13:24 |
|
| Eprouvettenschüttler/in |
 |
 |
Registriert: 29.09.2009, 18:39
Beiträge: 97
|
|
haha die sind lustig allesamt..na gut ich schreib einfach alles nochmal und gebs diesmal ohne einheitsangabe ab, mal sehen ...und beim 3. hab ich auch bei einheit pH hingeschrieben..naja dann lass ich das auch mal weg ...
_________________ ******I'm rolling Thunder, pouring Rain - I'm coming on like a HURRICANE******
|
|
  |
|
 |
|
lisasophie
|
Betreff des Beitrags: Re: 3.Einheit  Verfasst: Verfasst: 20.11.2009, 13:57 |
|
| Versuchskaninchen |
 |
 |
Registriert: 07.10.2009, 13:58
Beiträge: 13
|
beim ph wert einfach keine einheit hinschreiben oder halt einen strich hinmachen (wobei... dann bekommt man vlt wegen dem strich keinen punkt?!  habs selber so gemacht und einen punkt bekommen. und was bsp. 3.4 angeht: ich hab einen punkt dafür bekommen.. und mein ergebnis war ~2,88 ml. ich habs so gemacht, dass ich mir zuerst den ph-wert von der essigsäure-lösung ausgerechnet habe. und zwar weiß man ja dass 36 mg NaOH-plätzchen (mit 5% wassergehalt) dazukommen --> 36mg --> 0.036g --> mal 0,95 (nur 95% der plätzchen sind ja reines NaOH) --> 0,0342g NaOH mit n=m/M kann man sich jetzt die mol NaOH ausrechnen, mit der masn die reine essigsäurellösung versetzt.. und das sind ja auch gleichzeitig die x mol OH- die dazukommen laut der reaktionsgleichung (NaOH --> Na+ + OH- ;also 1mol --> 1mol + 1mol) mit dem säuregleichgewicht von HAc kann man sich die [Ac-] und [HAc] vor der Zugabe der OH- ausrechnen (bei [Ac-]: einfach aus dem Zusammenhang [H+]=[Ac-], nicht wie gewohnt zu [H+]² umformen,sondern eben zu [Ac-]²; und bei [Hac]: ausgangskonzentration ist gegeben --> und dann beide konzentrationen je mal das volumen in L, d.h. 0,5) was dann wichtig ist, ist die reaktionsgleichung von HAc + OH-: HAc + OH- --> H2O + Ac- daraus kann man erkennen, dass bei zugabe von x mol OH- (haben wir uns vorher schon ausgerechnet), die stoffmenge von HAc in der lösung genau um diese x mol weniger wird und die stoffmenge von Ac- genau um diese x mol mehr wird. d.h. von der [Hac] vor der OH- zugabe zieht man die x mol OH- (die zugegeben wurden) ab und bei der [Ac-] vor der OH- zugabe addiert man die x mol (ich glaube die x mol sind ca. 0.000855 mol) sooo... diese neuen konzentrationen setzt man ins säurengleichgewicht von HAc ein (Ks nachschauen =1,8 *10^-5) --> [H+] (das müssen so 0.0005797 mol/L gewesen sein) und diese [H+] ist ja nun genau die [H+] die wir auch in der verdünnten 32%igen salzsäurelösung haben wollen. die salzsäure wiederum ist eine starke säure, dissoziiert vollständig, d.h. die c0(HCl) = der [H+] - und die [H+] haben wir (in mol/L) .. also haben wir auch die ausgangskonzentration der HCl (in mol/L)! der pH-wert (und somit die [H+] soll aber nach einer 1:100 verdünnung gleich sein, d.h. man verdünnt 0.5L salzsäure (angabe) mit 50L wasser --> gesamtvolumen von 50,5L! laut schlussrechnung: 0.0005797 mol . . . . 1L 0.02927 mol . . . . . . . 50,5L mit der umgeformten formel m=n*M kann man sich jetzt die g (100%ige) HCl ausrechnen die in der lösung sein muss. (das sind 1.06736g) man hat aber laut angabe nur eine 32%ige HCl zur verfügung, d.h. 32g HCl . . . . 100g Lösung 1.067 g HCl . . . 3,335g Lösung! und jetzt hat mans fast geschafft: nun weiß man bereit wieviel gramm 32%ige HCl man benötigt, da aber ml gefragt sind muss man noch die gegebene dichte von 1,16g/ml miteinbeziehen (3.335 / 1,16) --> und so kommt man auf die 2,8754..... ml! hoffe das war nicht allzu verwirrend! liebe grüße an alle fleißigen rechner! 
|
|
  |
|
 |
|